Berikut ini soal kimia SMA bab Larutan penyangga/buffer dan pembahasannya:
Contoh cara menghitung pH larutan penyangga yang terdiri dari campuran asam lemah dan basa konjugasinya.
1. Berapa pH campuran yang terdiri atas 50 mL larutan CH3COOH 0,4 M dan 50 mL larutan CH3COONa 0,1 M bila Ka = 10–5?
1. Berapa pH campuran yang terdiri atas 50 mL larutan CH3COOH 0,4 M dan 50 mL larutan CH3COONa 0,1 M bila Ka = 10–5?
Pembahasan:
2. Sebanyak 10 mL larutan NH3 0,1 M (Kb = 10–5) dicampur dengan 100 mL larutan NH4Cl 0,1 M. Hitunglah pH larutan tersebut
Pembahasan:
Contoh cara menghitung pH larutan penyangga jika yang diketahui asam lemah dan basa kuat
3. Tentukan pH larutan bila 25 mL larutan CH3COOH 0,2 M dicampurkan dengan 25 mL larutan KOH 0,1 M jika Ka = 10–5!
Pembahasan:
4. Bila 50 mL larutan NH4OH 0,2 M dicampurkan ke dalam 50 mL larutan HCl 0,1 M. Hitung pH campuran yang terjadi jika Kb = 4 x 10–5!
Pembahasan:
Contoh cara menghitung pH larutan penyangga jika ditambahkan asam lemah atau basa lemah
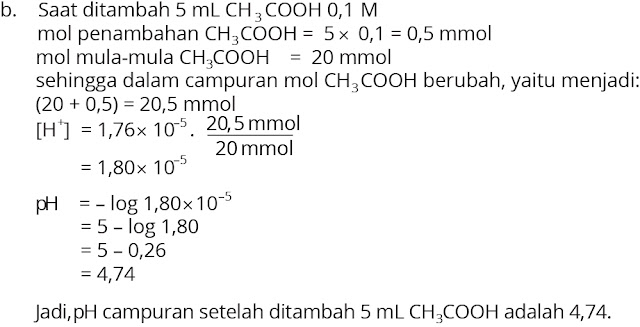
5. Sebuah campuran dibuat dengan mereaksikan 200 mL CH3COOH 0,1 M dengan 200 mL CH3COONa 0,1 M. Dengan harga Ka = 1,76 10–5, tentukan besarnya:
a. pH campuran buffer
b. pH campuran setelah ditambah 5 mL CH3COOH 0,1 M
c. pH campuran setelah ditambah 5 mL NH4OH 0,1 M
Pembahasan:








EmoticonEmoticon