Logam Alkali Tanah
Unsur-unsur alkali tanah dalam sistem periodik menempati golongan IIA. Unsur-unsur alkali tanah terdiri dari berilium (Be), magnesium (Mg), kalsium (Ca), stronsium (Sr), barium (Ba), dan radium (Ra). Disebut alkali tanah karena oksida dan hidroksida dalam air bersifat basa (alkalis) dan oksidanya serupa dengan Al2O3 dan oksida logam berat yang sejak semula dikenal dengan nama tanah.
 |
| Kalsium ( www.metabunk.org) |
Golongan ini mempunyai sifat-sifat yang mirip dengan golongan IA. Perbedaannya adalah bahwa golongan IIA ini mempunyai konfigurasi elektron ns2 dan merupakan reduktor yang kuat. Meskipun lebih keras dari golongan IA, tetapi golongan IIA ini tetap relatif lunak, perak mengkilat, dan mempunyai titik leleh dan kerapatan lebih tinggi.
A. Sifat-sifat Fisis
Unsur-unsur logam alkali tanah agak lebih keras, kekerasannya berkisar dari barium yang kira-kira sama keras dengan timbal, sampai berilium yag cukup keras untuk menggores kebanyakan logam lainnya.Unsur-unsur alkali tanah kecuali berilium (Be) semua merupakan logam putih keperakan dan lebih keras dari alkali.
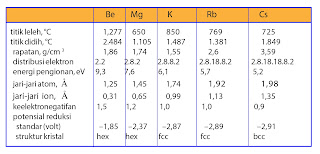
Berikut tabel sifat-sifat fisis logam alkali tanah
Berdasarkan tabel di atas terlihat dengan naiknya nomor atom, jari-jari atom bertambah panjang yang berakibat semakin lemahnya gaya tarik antaratom. Hal ini menyebabkan makin menurunnya titik leleh dan titik didih. Logam alkali tanah memiliki 2 elektron valensi sehingga ikatan logamnya lebih kuat daripada ikatan logam pada alkali seperiode. Hal ini menyebabkan titik leleh, titik didih, kerapatan, dan kekerasan alkali tanah lebih besar daripada logam alkali seperiode.
Struktur elektron golongan ini sederhana dan mempunyai 2 elektron yang relatif mudah dilepaskan. Selain energi ionisasi yang relatif rendah, keelektronegatifan rata-rata golongan alkali tanah juga rendah dikarenakan ukuran atomnya dan jarak yang relatif besar antara elektron terluar dengan inti.
B. Sifat-sifat Kimia
Alkali tanah merupakan golongan logam yang reaktif meskipun tidak sereaktif alkali. Kereaktifan logam alkali tanah meningkat dengan semakin meningkatnya jari-jari atom. Alkali tanah dapat bereaksi dengan hampir semua unsur nonlogam dengan ikatan ion (kecuali berilium yang membentuk ikatan kovalen). Logam alkali tanah mengalami reaksi redoks yang sama dengan logam alkali, hanya saja mereka melepaskan 2 elektron sehingga membentuk ion 2+.
Urutan kereaktifan logam alkali tanah adalah sebagai berikut:
Ba > Sr > Ca > Mg > Be
Reaksi-reaksi logam alkali tanah sebagai berikut.
1. Logam Alkali Tanah Bereaksi dengan Halogen
Logam alkali tanah bereaksi dengan halogen membentuk garam halida (MX2). Semua alkali tanah dapat bereaksi dengan halogen membentuk garam dengan ikatan ion kecuali berilium
Reaksi: M + X2⎯⎯→ MX2,
dengan:
M = Be, Mg, Ca, Sr, Ba
X = F, Cl, Br, I
Contoh:
Ca(s) + Cl2(g) → CaCl2(s)
2. Logam Alkali Tanah Bereaksi dengan Oksigen
Logam alkali tanah bereaksi dengan oksigen membentuk oksida (MO).
Reaksi:
2 M + O2 → 2 MO,
dengan
M = Be, Mg, Ca, Sr, Ba
Contoh:
2Ba(s) + O2(g) → 2BaO(s)
Berilium dan magnesium tidak begitu reaktif jika direaksikan dengan oksigen pada suhu kamar, tetapi keduanya mengeluarkan cahaya putih cerah jika dibakar dengan nyala api. Sedangkan kalsium, stronsium, dan barium cukup reaktif sehingga perlu disimpan di bawah minyak agar tidak kontak dengan udara.
Bila oksigen berlebih dan pada tekanan tinggi stronsium dan barium membentuk peroksida
Ba(s) + O2(g) → BaO2(s)
Kelarutan oksidanya semakin besar dari atas ke bawah.
3. Logam Alkali Tanah Bereaksi dengan Air
Logam alkali tanah bereaksi dengan air membentuk logam hidroksida [M(OH)2] (basa) dan gas hidrogen.
Reaksi:
M(s) + 2 H2O(l) → M2+ (aq) + 2 OH–(aq) + H2(g)
dengan:
M = Mg, Ca, Sr, atau Ba
Contoh:
Ca(s) + 2H2O(l) → Ca(OH)2(aq) + H2(g)
Kecuali berilium, semua logam alkali tanah bereaksi dengan air membentuk logam hidroksida M(OH)2. Magnesium bereaksi hanya jika suhu di atas 100 °C, sedangkan untuk kalsium dan stronsium, reaksi berjalan lambat dan pada suhu kamar. Hanya barium yang bereaksi dahsyat (Mc. Murry dan Fay, 2000: 223).
4. Reaksi dengan Hidrogen
5. Reaksi dengan Nitrogen
Reaksi alkali tanah dengan gas nitrogen membentuk nitrida.
3Mg(s) + N2(g) → Mg3N2(s) (Magnesium nitrida)
6. Reaksi dengan asam
Alkali tanah bereaksi dengan asam menghasilkan garam dan gas hidrogen. Reaksi semakin hebat dari atas ke bawah.
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
Berilium bersifat amfoter (dapat bereaksi dengan asam dan basa).
Reaksi berilium dengan basa kuat adalah sebagai berikut:
Be(s) + 2NaOH(aq) + 2H2O(l) →Na2Be(OH)4(aq) + H2(g)
7. Reaksi Nyala
Pada pemanasan/pembakaran senyawa alkali pada nyala api menyebabkan unsur alkali tereksitasi dengan memancarkan radiasi elektromagnetik sehingga memberikan warna nyala berilium (putih), magnesium (putih), kalsium (jingga merah), stronsium (merah), dan barium (hijau).
Kelarutan Basa Alkali Tanah dan Garamnya
Basa alkali tanah berbeda dengan basa alkali, basa alkali tanah ada yang sukar larut.
Tabel berikut menunjukkan harga hasil kelarutan (Ksp) dari basa alkali tanah.
Berdasarkan data Ksp di atas terlihat bahwa harga Ksp dari Be(OH)2 ke Ba(OH)2 makin besar, berarti hidroksida alkali tanah kelarutannya bertambah besar dengan naiknya nomor atom. Be(OH)2 dan Mg(OH)2 sukar larut, Ca(OH)2 sedikit larut, Sr(OH)2 dan Ba(OH)2 mudah larut. Be(OH)2 bersifat amfoter (dapat larut dalam asam dan basa kuat).
Be(OH)2 + 2H+ → Be2+ + 2H2O
Be(OH)2 + 2H– → BeO22– + 2H2O
Tabel berikut memperlihatkan harga hasil kali kelarutan (Ksp) beberapa garam alkali tanah.
Berdasarkan tabel Ksp di atas terlihat hasil kali kelarutan garam sulfat berkurang dari BeSO4 sampai BaSO4 berarti kelarutan garam sulfatnya dari atas ke bawah semakin kecil. Kelarutan garam kromat dari BeCrO4 sampai BaCrO4. Semua garam karbonatnya sukar larut, semua garam oksalatnya sukar larut kecuali MgC2O4 yang sedikit larut.
Jangan lupa like and share ya!
Jangan lupa like and share ya!



EmoticonEmoticon