Kenaikan Titik Didih dan Penurunan Titik Beku
Myrightspot.com-Jika ditanya berapa titik didih air? Pasti kalian akan menjawab 100°C bukan, sekarang coba kalian panaskan air sampai mendidih dan ukur suhunya. Berapakah suhunya? Apakah 100°C?
Titik didih air yang sering disebutkan 100°C adalah titik didih normal yaitu titik didih pada tekanan 760 mmHg. Titik didih dan titik beku suatu zat cair dipengaruhi oleh tekanan udara luar. Suatu zat cair mendidih pada saat tekanan uap jenuh cairan sama dengan tekanan udara luar. Di puncak gunung tekanan udara luar lebih rendah sehingga untuk menyamakan tekanan uap jenuh zat cair yang didihkan lebih cepat tercapai, hal ini berarti titik didihnya lebih rendah.
Demikian halnya pengaruh zat terlarut dalam zat cair (pelarut). Pada tekanan udara luar 760 mmHg, air mendidih pada suhu 100°C. Dengan adanya zat terlarut menyebabkan penurunan tekanan uap larutan, sehingga pada suhu 100°C larutan air belum mendidih karena tekanan uapnya belum mencapai 760 mmHg. Untuk mencapai tekanan uap 760 mmHg maka perlu dipanaskan lebih tinggi lagi akibatnya larutan mendidih pada suhu lebih dari 100°C. Ini berarti bahwa titik didih larutan lebih tinggi daripada titik didih pelarut murninya. Jadi, kenaikan titik didih (∆Tb ) adalah Selisih antara titik didih larutan dengan titik didih pelarut murni .
Kenaikan titit didih larutan dapat dituliskan:
Sebaliknya pada titik beku normal karena tekanan uap larutan juga lebih rendah daripada tekanan uap pelarut murni. Sehingga agar larutan membeku, harus didinginkan akibatnya titik beku larutan lebih rendah dari titik beku pelarut murni. Perubahan temperatur titik beku ini disebut penurunan titik beku larutan (∆Tf ).
Penurunan titik beku larutan dapat dituliskan:
Menurut Hukum Backman dan Raoult bahwa penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang terlarut di dalamnya.
Hukum tersebut dapat dirumuskan sebagai berikut
dengan:
∆Tb = kenaikan titik didih
Kb = tetapan kenaikan titik didih molal
∆Tf = penurunan titik beku
Kf = tetapan titik beku molal
m = molalitas
dengan molalitas larutan dapat dicari dengan rumus:
atau
dengan:
m= molalilas
Mr= massa molekul relatif
p= massa pelarut
Syarat Hukum Backman dan Raoult adalah sebagai berikut.
a. Rumus di atas berlaku untuk larutan nonelektrolit.
b. ∆Tb tidak berlaku untuk larutan yang mudah menguap.
c. Hanya berlaku untuk larutan yang sangat encer, pada larutan yang pekat terdapat penyimpangan.
Kenaikan Titik Didih dan Penurunan Titik Beku Larutan Elektrolit
Menurut Arrhenius, suatu zat elektrolit yang dilarutkan dalam air akan terurai menjadi ion-ion penyusunnya sehingga jumlah partikel zat pada larutan elektrolit akan lebih banyak dibandingkan dengan larutan nonelektrolit yang konsentrasinya sama. Hal ini menyebabkan sifat koligatif pada larutan elektrolit lebih besar daripada larutan nonelektrolit.
Hubungan sifat koligatif larutan elektrolit dan konsentrasi larutan dirumuskan oleh Van’t Hoff, yaitu dengan mengalikan rumus yang ada dengan bilangan faktor Van’t Hoff yang merupakan faktor penambahan jumlah partikel dalam larutan elektrolit.
Maka Kenaikan titik didih didihya dapat dituliskan menjadi
Sehingga rumus kenaikan titik didih larutan elektrolit adalah
Sehingga rumus penurunan titik beku larutan elektrolit adalah
Nilai faktor Van’t Hoff bisa dicari melalui
dengan:
i = faktor Van’t Hoff.
n = jumlah ion dari elektrolit
α = derajat ionisasi elektrolit, untuk elektrolit kuat α = 1, nonelektrolit α = 0, dan elektrolit lemah 0 < α < 1
faktor Van’t Hoff menunjukkan bagaimana larutan elektrolit dibandingkan dengan larutan nonelektrolit dengan molalitas yang sama.





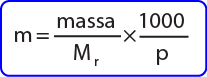



EmoticonEmoticon