A. Kekuatan Relatif Asam dan Basa
Berdasarkan banyaknya ion yang
dihasilkan pada ionisasi asam dan basa dalam larutan, maka kekuatan asam dan
basa dikelompokkan menjadi asam kuat dan asam lemah serta basa kuat dan basa
lemah.
Perbedaan kekuatan larutan asam-basa ini dipengaruhi oleh
banyak sedikitnya ion-ion pembawa sifat asam dan ion-ion pembawa sifat basa
yang dihasilkan saat terionisasi. Jadi Kekuatan asam dan basa tersebut
dipengaruhi dengan derajat ionisasi.
Derajat ionisasi (a) adalah perbandingan antara
jumlah molekul zat yang terionisasi dengan jumlah molekul zat mula-mula.
Diatas telah dijelaskan bahwa
kekuatan asam dan basa dipengaruhi derajat ionisasi, kemudian bagaimana jika
kedua senyawa memiliki derajat ionisasi yang sama?
Manakah asam yang lebih kuat
HCl atau HClO4 ?
keduanya memiliki derajat
ionisasi 1. Dengan demikian, nilai derajat ionisasi saja tidak cukup untuk
membandingkan kekuatan asam-basa.
Berdasarkan
konsep bronsted-lowry reaksi asam-basa adalah reaksi transfer proton. Dapat
dikatakan bahwa reaksi asam basa sebagai persaingan antar senyawa terhadap
pengikatan proton. Sehingga asam dapat diurutkan berdasarkan kemampuannya untuk
memberikan proton atau donor proton. Asam yang lebih kuat akan lebih mudah
melepaskan proton dibandingkan dengan asam lemah. Dan basa yang lebih kuat akan
lebih kuat mengikat proton dibandingkan dengan basa lemah.
Berikut ini tabel kekuatan relatif asam
B. Menghitung pH larutan Asam dan Basa
1. Konsep pH
Pada umumnya perhitungan mengenai [H+]
(konsentrasi H+) atau [OH–] (konsentrasi OH-) dalam
suatu larutan selalu menyangkut bilangan-bilangan yang sangat kecil, maka
menyederhanakannya bilangan-bilangan itu dinyatakan dalam harga logaritma
negatifnya. Penyederhanaan bilangan tersebut dikemukakan oleh S.P.L Sorensen seorang ahli kimia dari
Denmark pada tahun 1909 dengan mengajukan konsep pH (p berasal
dari kata potenz yang berarti pangkat dan H adalah tanda atom hidrogen).
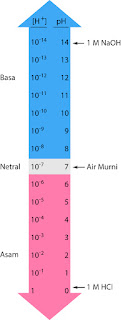
Pada suhu 25 °C harga derajat ionisasi air = 1,8 x 10-9
[H+] = [OH–] =
10–7 mol/L
Maka pada air murni berlaku:
Kw = [H+][OH–]
Kw = 10–7 x
10–7
Kw = 10–14
Kw adalah tetapan kesetimbangan ionisasi air, mempunyai
harga tetap pada temperatur tetap.
pKw = –log Kw =
–log 10–14 = 14
pH = –log [H+] = –log
10–7
pH = 7
pH = pOH = 7
Jadi air murni memiliki
pH= 7
hubungan pkw, pH dan pOH:
pKw = pH + pOH
2. Menghitung pH Larutan Asam
Besarnya [H+] dalam suatu
larutan merupakan salah satu ukuran untuk menentukan tingkat keasaman suatu
larutan.
Besarnya pH larutan asam dapat dihitung dengan rumus:
pH = –
log [H+]
Jadi untuk menghitung pH suatu
larutan perlu menentukan besar konsentrasi H+ dalam larutan tersebut
terlebih dahulu.
a. konsentrasi H+ Asam Kuat
Asam kuat yaitu senyawa asam yang dalam larutannya terion
seluruhnya menjadi ion-ionnya. Reaksi ionisasi asam kuat merupakan reaksi
berkesudahan.
Secara umum, ionisasi asam kuat dirumuskan sebagai
berikut.
HA(aq) → H+(aq) +
A–(aq)
dengan:
x = valensi asam
M = konsentrasi asam
Seperti yang telah dijelaskan pada Teori Asam basa
bahwa yang disebut valensi asam adalah
Jumlah ion H+ yang dapat dihasilkan oleh 1 molekul asam. Contohnya HCl memiliki
valensi asam 1, H2SO4 valensi asamnya 2.
b. konsentrasi H+ Asam Lemah
Asam lemah yaitu senyawa asam yang dalam larutannya hanya sedikit
terionisasi menjadi ion-ionnya. Reaksi ionisasi asam lemah merupakan reaksi
kesetimbangan.
Secara umum, ionisasi asam lemah valensi satu dapat
dirumuskan sebagai berikut.
HA(aq) «
H+(aq) + A–(aq)
karena pada asam lemah [H+] = [A–],
maka persamaan di atas dapat ditulis menjadi:
dengan
Ka = tetapan ionisasi asam
Makin kuat asam maka reaksi
kesetimbangan asam makin condong ke kanan, akibatnya Ka bertambah besar.
Harga Ka merupakan ukuran kekuatan asam, makin besar Ka makin
kuat asam.
Konsentrasi ion H+ asam lemah juga dapat
dihitung jika derajat ionisasinya (α) diketahui. Hubungan
konsentrasi ion H+, konsentrasi asam, dan derajat ionisasi adalah sebagai
berikut:
Semakin besar konsentrasi ion H+ maka semakin kecil pH larutannya. Karena pH dan konsentrasi
ion H+ dihubungkan dengan tanda negatif.
larutan yang nilai pH-nya berbeda sebesar n mempunyai
perbedaan ion H+ sebesar 10n karena bilangan dasar logaritma
adalah 10.
Contoh:
Jika konsentrasi ion H+ = 0,01 M, maka pH =
– log 0,01 = 2
Jika konsentrasi ion H+ = 0,001 M (10 kali lebih
kecil) maka pH = – log 0,001 = 3 (naik 1 satuan)
3. Menghitung pH larutan Basa
Besarnya [OH-] dalam suatu
larutan merupakan salah satu ukuran untuk menentukan tingkat kebasaan suatu
larutan.
Langkah-langkah yang dapat ditempuh untuk menentukan pH
larutan basa adalah sebagai berikut:
a. Mengklasifikasikan senyawa tersebut termasuk basa kuat
atau lemah.
b. Menghitung konsentrasi ion OH- dalam larutan.
c. Menghitung pOH larutan basa
d. Setelah berhasil menghitung pOH, pH larutan basa dapat
dengan mudah ditentukan.
Menghitung Konsentrasi OH- basa Kuat
Basa kuat yaitu senyawa basa yang dalam larutannya terion
seluruhnya menjadi ion-ionnya. Reaksi ionisasi basa kuat merupakan reaksi
berkesudahan. Secara umum, ionisasi basa kuat dirumuskan sebagai berikut.
M(OH)x(aq) ⎯⎯→ Mx+(aq) + x OH–(aq)
atau
dengan:
x = valensi basa
M = konsentrasi basa
Menghitung Konsentrasi OH- basa Lemah
Basa lemah yaitu senyawa basa yang dalam larutannya hanya sedikit
terionisasi menjadi ion-ionnya. Reaksi ionisasi basa lemah juga merupakan
reaksi kesetimbangan.
Secara umum, ionisasi basa lemah valensi satu dapat
dirumuskan sebagai berikut.
M(OH)(aq) ←⎯⎯⎯⎯→ M+(aq) + OH–(aq)
Berdasarkan persamaan di atas, karena pada basa lemah
[M+] = [OH–],
maka persamaan di atas dapat diubah menjadi:
dengan:
Kb = tetapan ionisasi basa
Konsentrasi ion OH– basa lemah juga dapat dihitung jika
derajat ionisasinya (α) diketahui.
Rumus menghitung konsentrasi OH- yang digunakan
tergantung dari data yang diketahui.
Harga Kb merupakan ukuran kekuatan basa, makin
besar Kb makin kuat basa. Makin kuat basa maka reaksi kesetimbangan basa
makin condong ke kanan, akibatnya Kb bertambah besar.
Jika konsentrasi OH- sudah
diketahui , pOH dapat dihitung dengan rumus:
pOH = –
log [OH–]
Sedangkan hubungan antara pH dan pOH adalah
pKw = pH
+ pOH
Pada suhu 25 ºC, pKw =
pH + pOH = 14.
Sehingga besarnya pH larutan basa dapat ditentukan dengan
pH= 14 - pOH
Dari uraian di atas dapat kita simpulkan bahwa:
a. Larutan bersifat netral jika [H+] = [OH–] atau pH
= pOH = 7.
b. Larutan bersifat asam jika [H+] > [OH–] atau pH
< 7.
c. Larutan bersifat basa jika [H+] < [OH–] atau pH
> 7.
C. Pengukuran pH Larutan
Untuk menentukan pH suatu larutan dapat dilakukan
dengan beberapa cara, antara lain sebagai berikut.
1. Menggunakan Beberapa Indikator
Indikator adalah asam organik lemah atau basa organik lemah yang
dapat berubah warna pada rentang harga pH tertentu. Harga pH
suatu larutan dapat diperkirakan dengan menggunakan trayek pH indikator.
Yang dimaksud dengan
trayek indikator adalah rentang perubahan warna larutan indikator. Indikator memiliki trayek perubahan warna yang
berbeda-beda. Dengan demikian dari uji larutan dengan beberapa indikator akan
diperoleh daerah irisan pH larutan.
Contoh, suatu larutan dengan brom
timol biru (6,0– 7,6) berwarna biru dan dengan fenolftalein (8,3–10,0) tidak
berwarna, maka pH larutan itu adalah 7,6–8,3. Hal ini disebabkan jika
brom timol biru berwarna biru, berarti pH larutan lebih besar dari 7,6
dan jika dengan fenolftalein tidak berwarna, berarti pH larutan kurang
dari 8,3.
2. Menggunakan Kertas Indikator Universal
 |
| Kertas Indikator Universal |
Alat yang sering digunakan dalam laboratorium adalah
kertas indikator universal dan pH meter. Penggunaan kertas indikator universal
dilakukan dengan meneteskan larutan yang akan diukur pH-nya. Kemudian warna
yang timbul pada kertas indikator dibandingkan dengan suatu kode warna untuk
menentukan pH larutan tersebut
3. Menggunakan pH–meter
 |
| pH–meter *www.conrad.com |
Alat pengukur pH
dengan ketelitian yang tinggi adalah pH–meter.
pH meter adalah suatu sel elektrokimia yang memberikan nilai pH dengan ketelitian
tinggi. Pada pH meter terdapat suatu elektrode yang sangat sensitif terhadap
molaritas ion H+ dalam larutan. Sebelum digunakan, pH meter dikalibrasi terlebih
dahulu dengan larutan standar yang sudah diketahui pH-nya.
Baca juga
Teori Asam Dan Basa Menurut Arrhenius, Bronsted-Lowry, dan Lewis
Soal latihan
Soal Kimia SMA Tentang Asam dan Basa Disertai Pembahasannya
Baca juga
Teori Asam Dan Basa Menurut Arrhenius, Bronsted-Lowry, dan Lewis
Soal latihan
Soal Kimia SMA Tentang Asam dan Basa Disertai Pembahasannya













EmoticonEmoticon