Termodinamika
Termodinamika
merupakan salah satu cabang ilmu fisika yang berfokus pada energi (terutama
energi panas) dan transformasinya. Transformasi energi pada termodinamika
berlandaskan pada dua hukum, yaitu hukum pertama termodinamika yang merupakan
pernyataan lain dari hukum kekekalan energi dan hukum kedua termodinamika yang
memberi batasan apakah suatu proses dapat berlangsung atau tidak. Sebelum
mempelajari hukum-hukum termodinamika kita perlu terlebih dahulu memahami apa
yang dimaksud sistem dan lingkungan.
Dengan berkembangnya ilmu pengetahuan dan
teknologi, maka prinsip alamiah dalam berbagai proses termodinamika
direkayasa menjadi berbagai bentuk mekanisme untuk membantu manusia dalam
menjalankan kegiatannya. Mesin-mesin transportasi darat, laut, maupun udara
merupakan contoh yang sangat kita kenal dari mesin konversi energi, yang
merubah energi kimia dalam bahan bakar atau sumber energi lain menjadi energi
mekanis dalam bentuk gerak atau perpindahan diatas permukaan bumi.
Hukum-Hukum Termodinamika
Hukum-hukum
termodinamika pada prinsipnya menjelaskan peristiwa perpindahan panas dan kerja pada
proses termodinamika.
Sejak perumusannya, hukum-hukum ini telah menjadi salah satu hukum terpenting
dalam fisika dan
berbagai cabang ilmu lainnya yang berhubungan dengan termodinamika. Hukum-hukum
ini sering dikaitkan dengan konsep-konsep yang jauh melampau hal-hal yang
dinyatakan dalam kata-kata rumusannya.
Hukum-hukum dasar yang berlaku di dalam
termodinamika,yaitu:
Hukum 0 Termodinamika (Zeroth Law/Hukum ke-0)
Bunyi Hukum 0 Termodinamika :
"Jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka mereka berada dalam kesetimbangan termal satu sama lain"
Hukum I Termodinamika
Hukum I termodinamika menyatakan bahwa untuk setiap proses apabila kalor (Q)
diberikan kepada sistem dan sistem melakukan usaha (W), maka akan
terjadi perubahan energi dalam (∆U).
Rumus/Persamaan Hukum 1 Termodinamika adalah
sebagai berikut:
Q = kalor/panas yang diterima/dilepas (J)
W = energi/usaha (J)
∆U = perubahan energi (J)
Peraturan tanda
positif dan negatif adalah sebagai berikut:
1. Q dianggap
positif (+) apabila kalor memasuki sistem.
2. W dianggap
positif (+) apabila usaha dilakukan oleh sistem.
3. ∆U dianggap positif (+)
apabila energi dalam sistem bertambah.
4. Q dianggap
negatif (–) apabila kalor keluar dari sistem.
5. W dianggap
negatif (–) apabila lingkungan melakukan usaha pada sistem.
6. ∆U dianggap
negatif (–) apabila energi dalam sistem berkurang.
Perubahan energi dari sebuah sistem hanya
tergantung pada transfer panas ke dalam sistem dan kerja yang dilakukan oleh
sistem dan tidak bergantung pada proses yang terjadi. Pada hukum ini tidak ada
petunjuk adanya arah perubahan dan batasan-batasan lain.
Hukum pertama Termodinamika dibagi menjadi 4 proses yaitu
:
Proses
Isotermal ( Suhu Konstan )
Proses isotermal adalah proses yang dialami gas pada suhu tetap. Usaha yang dilakukan gas
pada proses ini tidak dapat dihitung dengan persamaan W = p × ∆V . Hal ini dikarenakan
tekanannya tidak konstan. Untuk menghitung usaha pada proses isotermal dapat
digunakan rumus integral berikut:
atau juga dapat dituliskan
Karena suhunya tetap maka
pada proses isotermis ini tidak terjadi perubahan energi dalam ∆U=O, sehingga
Q = W
Dalam berntuk kurva, proses isotermal dapat digambarkan sebagai berikut:
Proses
Isobarik ( Tekanan Konstan )
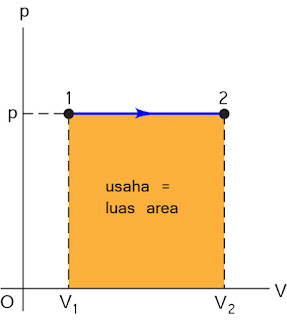
Proses isobarik adalah proses perubahan gas dengan tekanan tetap. Jika Volume gas
bertambah berarti gas melakukan usaha atau usaha gas bernilai positif(gas
melakukan ekspansi). Sedangkan
gas mengalami kompresi jika volumenya berkurang dan usaha gas negatif( dilakukan usaha
pada gas).
Usaha yang dilakukan
oleh gas pada proses isobarik besarnya sebagai berikut
Sehingga
DU = Q – W
Usaha yang dilakukan
gas terhadap lingkungannya atau kebalikannya sama dengan luas daerah bawah
grafik tekanan terhadap volume, seperti yang ditunjukkan gambar berikut:
Proses Isokhoris ( Volume
Konstan )
Proses
isokhoris adalah proses perubahan gas dengan volume tetap. Karena volumenya tetap
berarti usaha yang
dilakukan gas pada proses isokorik adalah nol.
W = 0
Sehingga
DU = Q
Grafik proses isokhoris adalah sebagai berikut:
Proses Adiabatis (
Kalor Tetap )
Proses adiabatik merupakan proses yang tidak ada kalor yang masuk atau keluar dari sistem
(gas) ke lingkungan (DQ = 0) . Hal ini dapat
terjadi apabila terdapat sekat yang tidak menghantarkan kalor atau prosesnya
berlangsung cepat.
Q = 0
usaha yang dilakukan
oleh sistem pada proses adiabatik dapat dituliskan:
W = -DU
Kurva perbandingan isotermal dan Adiabatik
Hukum II Termodinamika
Hukum pertama termodinamika telah menjelaskan
bahwa energi dapat diubah dari satu bentuk energi ke bentuk energi lainnya,
akan tetapi belum membatasi bagaimana perubahan energi tersebut berlangsung. Hukum
kedua ini membatasi perubahan energi mana yang dapat terjadi dan yang tidak.
Bunyi
Hukum II Termodinamika dalam pernyataan aliran kalor :
"Kalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam arah kebalikannya."
Hukum II termodinamika dalam pernyataan
tentang mesin kalor
“Tidak mungkin membuat suatu mesin kalor yang bekerja dalam suatu siklus yang semata-mata menyerap kalor dari sebuah reservoir dan mengubah seluruhnya menjadi usaha luar”
Hukum II termodinamika dalam pernyataan
entropi
“besaran termodinamika yang menyertai perubahan setiap keadaan dari awal sampai akhir sistem dan menyatakan ketidakteraturan suatu sistem”
Berikut Soal-soal tentang termodinamika dan pembahasannya, kerjakan soal tersebut untuk mengetahui sejauh mana pemahaman kalian.







EmoticonEmoticon