Hidrolisis garam
Hidrolisis
adalah istilah umum untuk reaksi zat dengan air (hidrolisis berasal dari kata hidro
yang berarti air dan lisis yang berarti peruraian). Hidrolisis garam
merupakan reaksi antara air dengan ion-ion yang berasal dari asam lemah atau
basa lemah dari suatu garam.
Ion-ion yang berasal dari asam lemah
(misalnya CH3COO–, CN–, dan S2–)
atau ion-ion yang berasal dari basa lemah (misalnya NH4+,
Fe2+, dan Al3+) akan bereaksi
dengan air membentuk ion H3O+ (= H+) atau ion OH–.
Reaksi suatu ion dengan air inilah yang disebut hidrolisis. Berlangsungnya
hidrolisis disebabkan adanya kecenderungan ion-ion tersebut untuk membentuk
asam atau basa asalnya. Jika hidrolisis menghasilkan ion H3O+
maka larutan bersifat asam, tetapi jika hidrolisis menghasilkan ion OH–
maka larutan bersifat basa.
Dari
penjelasan diatas dapat diketahui bahwa hidrolisis garam hanya terjadi jika
salah satu komponen penyusun garam tersebut berupa asam lemah dan atau basa
lemah. Jika garam yang terbentuk berasal asam kuat dan basa kuat, maka garam
tersebut bersifat netral sehingga tidak akan terhidrolisis.
Macam-macam Hidrolisis Garam
Sifat larutan garam itu bergantung pada
kekuatan relatif asam dan basa penyusunnya.
Berdasarkan asam dan basa penyusunnya,
garam dapat dikelompokkan menjadi 4 macam sebagai berikut.
Cara Menghitung ph Larutan garam
Pada prinsipnya
dalam menghitung pH reaksi hidrolisis adalah
menggunakan reaksi kesetimbangan. Walaupun jumlah garam yang terhidrolisis
hanya sedikit, tetapi hal itu bisa merubah pH larutan.
Pada
hidrolisis garam dikenal istilah tetapan hidrolisis (Kh) yang digunakan untuk
menunjukkan kesetimbangan hidrolisis secara kuantitatif. Tetapan hidrolisis
(Kh) terkait dengan tetapan ionisasi asam (Ka) dan tetapan ionisasi basa (Kb)
serta dapat digunakan untuk menentukan pH larutan garam.
1. Hidrolisis Garam dari Asam lemah dan Basa Kuat
Jika suatu
garam dari asam lemah dan basa kuat dilarutkan dalam air, maka kation dari basa
kuat tidak terhidrolisis sedangkan anion dari asam lemah akan mengalami
hidrolisis. Jadi garam dari asam lemah dan basa kuat jika dilarutkan dalam air
akan mengalami hidrolisis parsial atau hidrolisis sebagian. pH garam dari asam lemah dan basa kuat lebih besar dari 7 (pH > 7)
sehingga larutan garam bersifat basa.
dengan:
Kw = tetapan kesetimbangan air
Ka = tetapan ionisasi asam lemah
2. Hidrolisis Garam dari Asam Kuat dan Basa Lemah
Garam dari asam kuat dan basa lemah
jika dilarutkan dalam air juga akan mengalami hidrolisis sebagian. Hal ini disebabkan
karena kation dari basa lemah dapat terhidrolisis, sedangkan anion dari asam
kuat tidak mengalami hidtrolisis. pH garam
dari asam kuat dan basa lemah kurang dari
7( pH < 7) sehingga larutan garam bersifat asam
dengan:
Kw = tetapan kesetimbangan air
Kb = tetapan ionisasi basa lemah
3. Hidrolisis Garam dari Asam Lemah dan Basa Lemah
Garam yang berasal dari asam lemah dan
basa lemah dalam air mengalami hidrolisis total. Hal ini terjadi karena kation
dari basa lemah maupun anion dari asam lemah dapat mengalami hidrolisis menghasilkan
ion H+ dan ion OH– sehingga harga pH larutan ini
tergantung harga Ka dan Kb.
Berdasarkan
rumus di atas dapat kita ketahui bahwa harga pH larutan garam yang
berasal dari asam lemah dan basa lemah tidak tergantung pada konsentrasi
ion-ion garam dalam larutan, tetapi tergantung pada harga Ka dan Kb dari
asam dan basa pembentuknya.
Jika Ka = Kb maka larutan akan
bersifat netral (pH = 7)
Jika Ka > Kb maka larutan
akan bersifat asam (pH < 7)
Jika Ka < Kb maka
larutan akan bersifat basa (pH > 7)
4. Garam yang terbentuk dari asam kuat dan basa kuat
Garam yang berasal dari asam kuat dan
basa kuat dalam air tidak mengalami hidrolisis. Karena kedua komponen garam
tidak terhidrolisis sehingga pH larutan sama dengan air yaitu pH
= 7 bersifat netral.
Soal latihan
Soal tentang hidrolisis garam dan pembahasannya
Kumpulan soal kimia tentang hidrolisis garam
Soal latihan
Soal tentang hidrolisis garam dan pembahasannya
Kumpulan soal kimia tentang hidrolisis garam








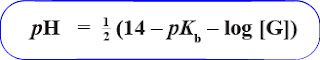


2 comments
Write commentsKw biasanya berapa ya?
Replynilai kw adalah 10 pangkat minus 14
ReplyEmoticonEmoticon