Persamaan laju reaksi dan orde reaksi
Persamaan laju reaksi menyatakan hubungan kuantitatif antara laju reaksi dengan molaritas reaktan. Persamaan laju reaksi dikenal sebagai hukum laju reaksi.
Misalkan ada sebuah reaksi:
pA + qB ⎯⎯→ rC + sD
maka,
Persamaan laju reaksinya dapat ditulis sebagai:
Dengan:
k = tetapan laju reaksi
x = orde atau tingkat reaksi terhadap zat A
y = orde atau tingkat reaksi terhadap zat B
Tetapan laju reaksi disimbolkan dengan k. Harga k bergantung pada jenis reaksi dan suhu. Setiap jenis reaksi mempunyai harga k tertentu. Harga k ini tetap untuk suatu reaksi, dan dipengaruhi oleh suhu dan katalis. Jika reaksi berlangsung cepat, maka harga k besar. Begitu pula sebaliknya. Jika reaksi berlangsung lambat, maka harga k kecil.
Pada persamaan laju reaksi juga terdapat orde reaksi. Apa orde reaksi itu? Orde reaksi adalah pangkat molaritas pada persamaan laju reaksi. Orde reaksi disebut juga tingkat reaksi. Nilai orde reaksi tidak dilihat dari koefisien reaksinya saja. Untuk menentukan orde reaksi diperlukan percobaan.
Berarti x merupakan orde reaksi A dan y merupakan orde reaksi B. Penjumlahan masing-masing orde reaktan merupakan orde reaksi total, yaitu x + y. Pada umumnya, harga orde reaksi merupakan bilangan bulat sederhana, yaitu 1, 2, atau 3, tetapi juga terdapat pereaksi yang mempunyai orde reaksi 0, ½, atau bahkan negatif.
Arti Orde Reaksi Suatu Persamaan Reaksi
Orde reaksi menyatakan besarnya pengaruh konsentrasi pereaksi pada laju reaksi.
Arti orde reaksi yang sering ditemukan pada persamaan reaksi:
Reaksi Orde Negatif
Suatu reaksi kimia dikatakan mempunyai orde negatif, apabila besarnya laju reaksi berbanding terbalik dengan konsentrasi pereaksi. Artinya, jika konsentrasi pereaksi dinaikkan atau diperbesar, maka laju reaksi justru akan menjadi lebih kecil.
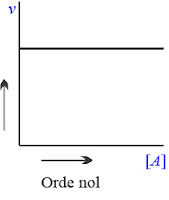
Reaksi Orde Nol
Suatu reaksi kimia dikatakan mempunyai orde nol, jika besarnya laju reaksi tersebut tidak dipengaruhi oleh konsentrasi pereaksi. Artinya, seberapapun peningkatan konsentrasi pereaksi tidak akan mempengaruhi besarnya laju reaksi.
Grafik reaksi orde nol akan seperti berikut:
Reaksi Orde Satu
Suatu reaksi kimia dikatakan mempunyai orde satu, apabila besarnya laju reaksi berbanding lurus dengan besarnya konsentrasi pereaksi. Artinya, jika konsentrasi pereaksi dinaikkan dua kali semula, maka laju reaksi juga akan meningkat besarnya sebanyak (2)1 atau 2 kali semula.
Grafik reaksi orde satu dapat digambarkan seperti berikut:
Reaksi Orde Dua
Suatu reaksi dikatakan mempunyai orde dua, apabila besarnya laju reaksi merupakan pangkat dua dari peningkatan konsentrasi pereaksinya. Artinya, jika konsentrasi pereaksi dinaikkan 2 kali semula, maka laju reaksi akan meningkat sebesar (2)2 atau 4 kali semula. Dan jika konsentrasi pereaksi dinaikkan 3 kali semula, maka laju reaksi akan menjadi (3)2 atau 9 kali semula.
Grafik reaksi orde dua dapat digambarkan seperti berikut:
Baca juga
Soal latihan
Kumpulan Soal kimia SMA tentang Laju Reaksi
Soal Kimia Tentang Laju Reaksi dan Pembahasannya



EmoticonEmoticon