1. Model atom Dalton
Teori atom Dalton dikemukakan berdasarkan dua hukum, yaitu hukum kekekalan massa dan hukum perbandingan tetap. Teori atom Dalton dikembangkan selama periode 1803-1808, yaitu:
a. Materi tersusun atas partikel-partikel terkecil yang disebut atom.
b. Atom-atom penyusun unsur bersifat identik (sama dan sejenis).
c. Atom suatu unsur tidak dapat diubah menjadi atom unsur lain.
d. Senyawa tersusun atas 2 jenis atom atau lebih dengan perbandingan tetap dan tertentu.
e. Pada reaksi kimia terjadi penataulangan atom-atom yang bereaksi. Reaksi kimia terjadi karena pemisahan atom-atom dalam senyawa untuk kemudian bergabung kembali membentuk senyawa baru.
 |
| Model atom menurut Dalton berbentuk bola pejal |
2.Model Atom Thomson
Setelah tahun 1897 Joseph John Thomson berhasil membuktikan dengan tabung sinar katode bahwa sinar katode adalah berkas partikel yang bermuatan negatif (berkas elektron) yang ada pada setiap materi maka tahun 1898 J.J.Thomson membuat suatu teori atom. Menurut Thomson, atom berbentuk bulat di mana muatan listrik positif yang tersebar merata dalam atom dinetralkan oleh elektron-elektron yang berada di antara muatan positif. Elektron-elektron dalam atom diumpamakan seperti butiran kismis dalam roti, maka Teori Atom Thomson juga sering dikenal Teori Atom Roti Kismis.
 |
| Model atom menurut Thomson |
3. Teori Atom Rutherford
Dengan bantuan kedua muridnya Hans Geiger dan Ernest Marsden, Rutherford melakukan percobaan dengan hamburan sinar α. Partikel α bermuatan positif. Berdasarkan percobaan tersebut disimpulkan bahwa:
 |
| Ilustrasi penghamburan sinar alfa |
a. Sebagian besar ruang dalam atom adalah ruang hampa; partikel α diteruskan.
b. Di dalam atom terdapat suatu bagian yang sangat kecil dan padat yang disebut inti atom;
partikel α dipantulkan kembali oleh inti atom.
c. Muatan inti atom dan partikel α sejenis yaitu positif; sebagian kecil partikel α dibelokkan.
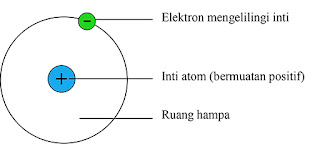 |
| Model atom menurut Rutherford |
Hasil percobaan tersebut menggugurkan teori atom Thomson. Kemudian Rutherford mengajukan teori atom sebagai berikut:
a. Atom tersusun dari:
1) Inti atom yang bermuatan positif.
2) Elektron-elektron yang bermuatan negatif dan mengelilingi inti.
b. Semua proton terkumpul dalam inti atom, dan menyebabkan inti atom bermuatan positif.
c. Sebagian besar volume atom merupakan ruang kosong. Hampir semuamassa atom terpusat pada inti atom yang sangat kecil. Jari-jari atom sekitar 10–10 m, sedangkan jari-jari inti atom sekitar 10–15 m.
Teori atom Rutherford hanya mampu menjelaskan bahwa elektron-elektron yang beredar mengelilingi inti atom berada dalam ruang hampa, tetapi belum mampu menjelaskan distribusi elektron-elektron secara jelas.
Kelemahan dari teori atom Rutherford tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari inti ini disertai pemancaran energi sehingga lamakelamaa nenergi elektron akan berkurangdan lintasannya makin lama akan mendekati inti dan jatuh ke dalam inti.
4. Model Atom Niels Bohr
Pada tahun 1913, seorang ilmuwan dari Denmark yang bernama Niels Henrik David Bohr menyempurnakan model atom Rutherford. Berdasarkan hasil pengamatannya pada spektrum atom hidrogen, Neils Bohr menyusun model atom sebagai berikut:
a. atom terdiri atas inti atom yang mengandung proton bermuatan positif dan elektron bermuatan negatif yang mengelilingi inti atom;
b. elektron-elektron yang mengelilingi inti atom berada pada tingkat energi tertentu yang bergerak secara stasioner;
c. tingkat energi atau lintasan elektron yang paling dekat dengan inti atom mempunyai tingkat energi terendah, lintasan elektron yang paling jauh dari inti atom memiliki tingkat energi tertinggi;
d. elektron dapat berpindah dari lintasan yang satu ke lintasan yang lain dengan menyerap atau melepaskan energi;
5. Model atom mekanika kuantum
Model atom mekanika kuantum didasarkan pada:
a. elektron bersifat gelombang dan partikel, oleh Louis de Broglie (1923);
b. persamaan gelombang elektron dalam atom, oleh Erwin Schrodinger; (1926)
c. asas ketidakpastian, oleh Werner Heisenberg (1927).
 |
| model atom mekanika modern |
Menurut teori atom mekanika kuantum, elektron tidak bergerak pada lintasan
tertentu. Berdasarkan hal tersebut maka model atom mekanika kuantum adalah sebagai
berikut:
b. Atom terdiri atas inti atom yang mengandung proton dan neutron, dan elektronelektron
mengelilingi inti atom berada pada orbital-orbital tertentu yang membentuk kulit atom, hal ini disebut dengan konsep orbital.
b. Dengan memadukan asas ketidakpastian dari Werner Heisenberg dan mekanika gelombang dari Louis de Broglie, Erwin Schrodinger merumuskan konsep orbital sebagai suatu ruang tempat peluang elektron dapat ditemukan.
c. Kedudukan elektron pada orbital-orbitalnya dinyatakan dengan bilangan kuantum.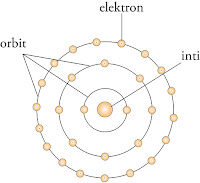
EmoticonEmoticon